Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.

Исследование эффективности лечения мелазмы методом комбинированного применения аутологичной плазмы, дермального оптического термолиза и радиочастотного воздействия
Журнал: Клиническая дерматология и венерология. 2024;23(4): 467‑474
Прочитано: 1237 раз
Как цитировать:
Мелазма представляет собой доброкачественное приобретенное нарушение пигментации, которое проявляется в виде симметрично расположенных пятен неправильной формы от желтовато-коричневого до темно-коричневого цвета с преимущественной локализацией в скуловой зоне щек, на лбу, подбородке, в области нижней челюсти и верхней губы [1]. Помимо избыточного накопления меланина гиперпигментация может быть связана с повышением содержания в коже другого хромофора ― гемоглобина [2]. Распространенность мелазмы варьирует в зависимости от этнической принадлежности, фототипа кожи и интенсивности воздействия на кожу ультрафиолетовых лучей. Если в общей популяции показатель составляет 1%, то среди людей с III—VI фототипом по классификации Фитцпатрика он может достигать 40—50% [3, 4]. Наиболее часто мелазма встречается у женщин репродуктивного возраста (20—40 лет) [1, 5].
Сравнены различные способы введения аутологичной плазмы крови (АПК), так как ее использование рекомендовано как инъекционный метод для всех видов мелазмы [6].
Развитие мелазмы происходит в результате ряда сложных патофизиологических процессов, возникающих под действием эндогенных и экзогенных факторов. Кроме избыточной активации меланоцитов авторы исследований [7, 8] отмечают гистологические нарушения, обусловленные фотостарением кожи, в том числе агрегацию меланина и меланосом в дерме и эпидермисе, увеличение числа тучных клеток, солнечный эластоз, нарушение целостности базальной мембраны и усиление васкуляризации. Среди триггерных факторов ведущую роль отводят воздействию ультрафиолетового излучения, наследственной предрасположенности, изменению гормонального фона, в том числе на фоне беременности и получения заместительной гормональной терапии или приема комбинированных оральных контрацептивов [3, 5]. Как показывают исследования, усиление процесса меланогенеза также может наблюдаться при применении лекарственных препаратов и косметических средств, обладающих фотосенсибилизирующим действием [9].
В зависимости от глубины залегания избыточного меланина выделяют следующие гистологические типы мелазмы: эпидермальная, дермальная и дермоэпидермальная (смешанная).
В настоящее время в распоряжении эстетической медицины есть широкий спектр методов лечения, обладающих разной степенью эффективности: лекарственные препараты для наружного применения, химические пилинги, лазерная терапия, микронидлинг, радиочастотная (РЧ) терапия и др. [1, 9]. Современные методы лечения направлены на устранение этиологических и патогенетических факторов с воздействием на клетки дермы и эпидермиса, регулирующие активность меланоцитов, и коррекцию изменений, вызванных фотостарением [2, 10—12]. В качестве терапии первого ряда для лечения мелазмы используют топические средства (монотерапия или комбинации), способствующие ингибированию продукции меланина путем воздействия на различные звенья патогенеза. Так, гидрохинон, азелаиновая кислота, арбутин, койевая и транексамовая кислоты [12] ингибируют тирозиназу ― фермент, участвующий в синтезе меланина. Ретиноиды (третиноин, изотретиноин, адапален) сокращают время контакта между кератиноцитами и меланоцитами путем отшелушивания рогового слоя и обновления эпидермиса [10—12]. Однако применение наружных средств в некоторых случаях сопровождается развитием побочных эффектов (контактного дерматита, поствоспалительной гиперпигментации), а эффект зачастую достигается только после длительного курса лечения, при этом после его прекращения не исключено развитие рецидивов [1—3, 10].
Одним из эффективных методов коррекции мелазмы считается химический пилинг с применением гликолевой [1, 13, 14], салициловой [13, 14], молочной, ретиноевой [13] и других кислот. При этом химический пилинг характеризуется длительным периодом реабилитации, необходимостью проведения нескольких процедур и может вызывать раздражение кожи с дальнейшим развитием диспигментации [10].
В последнее время в литературе все чаще поднимается вопрос применения АПК для лечения мелазмы. АПК представляет собой биологический препарат, получаемый путем центрифугирования цельной крови пациента и содержащий повышенную концентрацию тромбоцитов. АПК содержит более 30 факторов роста, способных посредством различных сигнальных путей уменьшать процесс меланогенеза [16, 17]. Трансформирующий фактор роста β1 посредством снижения активности фактора транскрипции способствует уменьшению экспрессии тирозиназы и тирозиназа-зависимых белков, ингибируя тем самым синтез меланина [17, 18]. При этом эпидермальный фактор роста воздействует на меланогенез, модулирует активность провоспалительных медиаторов (в том числе простагландина Е2) и способствует дозозависимому снижению активности тирозиназы [17, 19, 20]. Однако, несмотря на значительный интерес к данной технологии и ее высокий уровень безопасности [16, 21], можно отметить недостаточное количество рандомизированных контролируемых исследований с высоким уровнем доказательности, посвященных применению АПК как в виде монотерапии, так и в комбинации с другими методами лечения.
Среди методов лечения мелазмы отдельная роль отводится методам энергетического воздействия: лазерной терапии, импульсной световой терапии, РЧ-терапии, эффективность которых подтверждена во многих исследованиях [11, 14, 15]. В частности, для коррекции гиперпигментации кожи зачастую прибегают к применению лазерной терапии, в основе действия которой лежит принцип селективного фототермолиза, то есть поглощения волн разной длины разными хромофорами кожи и разрушения молекул-мишеней без повреждения окружающих тканей. Наибольшее распространение для лечения мелазмы получили абляционные эрбиевые и CO2-лазеры [1], лазеры с модуляцией добротности (Q-switched): рубиновый, александритовый и Nd:YAG-лазер, а также длинноимпульсные лазеры [10]. Неабляционные лазеры считаются более предпочтительными для лечения мелазмы из-за меньшей частоты возникновения поствоспалительной гиперпигментации вследствие прямого повреждения кожи. Вместе с тем появление технологии фракционного лазерного воздействия позволило минимизировать вероятность остаточного повреждения кожных структур и решить проблему возникновения поствоспалительной пигментации.
Представляется целесообразным более пристальное изучение комбинированного применения методов, оказывающих умеренный или выраженный эффект на мелазму. К таким методам относятся дермальный оптический термолиз, РЧ-воздействие и введение АПК.
Проспективное открытое одноцентровое рандомизированное исследование эффективности лечения мелазмы в параллельных группах проведено на базе клиники «Дека Медикал» (Москва).
В исследовании могли принимать участие женщины в возрасте 18—70 лет включительно с диагнозом эпидермальной, дермальной или смешанной мелазмы (фототип кожи II, III или IV по классификации Фитцпатрика), постоянно проживающие в Москве или Московской области и предоставившие подписанное информированное согласие. К участию в исследовании среди прочих не допускались пациентки с противопоказаниями к применению исследуемых методов лечения и физиотерапевтических процедур, беременные и кормящие женщины, лица с системными заболеваниями соединительной ткани, заболеваниями щитовидной железы, инфекционными заболеваниями кожи, множественными новообразованиями в зоне воздействия (пигментные невусы), со склонностью к образованию келоидных или гипертрофических рубцов, а также с наличием небиодеградируемых филлеров, нитей и имплантатов в области воздействия. Пациенток исключали из исследования в случае отзыва информированного согласия на любом этапе исследования, наступления беременности, нарушения рекомендаций врача и несоблюдения графика визитов, а также при развитии нежелательных явлений (НЯ) или сопутствующих заболеваний/симптомов, препятствующих дальнейшему проведению исследования.
По мере включения в исследование пациенток рандомизированно распределяли в соотношении 1:1 в две группы: основную группу, в которой применяли лазерную и РЧ-терапию и вводили АПК, и контрольную группы, в которой вводили только АПК. С учетом открытого дизайна исследования слепой метод не применяли.
Следует заметить, что в обеих группах для ингибирования активности тирозиназы все пациентки до проведения процедур использовали азелаиновую кислоту в виде крема 20% однократно на ночь в течение 2 мес. На протяжении исследования в дневное время все пациентки использовали солнцезащитный крем с SPF50.
В исследование вошли 28 женщин европеоидной расы (по 14 человек в каждой группе) в возрасте 23—58 лет с мелазмой при длительности пигментации от 2 до 20 лет.
До начала процедур выполняли физикальный осмотр с измерением основных показателей жизнедеятельности (температура тела, артериальное давление, частота сердечных сокращений и дыхательных движений), сбор данных анамнеза, оценку степени тяжести мелазмы и определение ее типа в лучах лампы Вуда. Для снижения болевых ощущений во время процедуры на пораженный участок наносили местный анестетик акриол Про (под пленку) на 30—40 мин. У пациенток основной группы предварительно забирали по 25—30 мл цельной крови для последующего двойного центрифугирования с получением плазмы, обогащенной тромбоцитами (platelet-rich plasma — PRP). После этого на область поражения воздействовали фракционным СО2-лазером (система SmartXide DOT 2+RF) в режиме Normal с выбором параметров в зависимости от толщины кожи и глубины залегания пигмента. Затем при помощи иглы 30G в зону поражения вводили препарат АПК на глубину 4 мм с последующим проведением РЧ-воздействия (мощность 6—7 Вт, длительность 2—3 с). Пациенткам контрольной группы выполняли те же процедуры, при этом в качестве терапии применяли только АПК. После завершения процедур обрабатывали зону воздействия хлоргексидином и наносили успокаивающий крем (бепантен).
Для клинической оценки степени тяжести мелазмы использовали общепринятые специализированные инструменты: шкалу общей оценки состояния кожи исследователем (Investigator’s Global Assessment — IGA), шкалу оценки степени тяжести мелазмы (Melasma Severity Scale — MSS), а также индекс площади и степени тяжести мелазмы (Melasma Area and Severity Index — MASI). Эффективность применяемых методов лечения определяли при снижении MASI, показателей по шкалам IGA, MSS и концентрации пигментов кожи (меланина и гемоглобина) по сравнению с исходным уровнем. На визите завершения исследования врач и пациент оценивали эффективность процедур в баллах при помощи шкалы общего эстетического улучшения (Global Aesthetic Improvement Scale — GAIS).
Анализ безопасности и переносимости процедур проводили на основе данных о НЯ, регистрируемых на протяжении всего исследования со слов пациента, а также на основании результатов физикального осмотра, измерения основных показателей жизнедеятельности, визуального осмотра обрабатываемых участков кожи и прицельного опроса пациентов.
Статистическую обработку и анализ полученных данных выполняли с помощью программного обеспечения AtteStat, а для подготовки графиков и таблиц использовали программу Microsoft Excel. Для доказательства того, что исследуемый метод лечения по эффективности превосходит метод сравнения, рассчитывали двусторонние 95% доверительные интервалы (ДИ) различия в снижении каждого анализируемого показателя между группами. Вывод о наличии превосходства делали в том случае, если значение нижней границы двустороннего 95% ДИ было больше нуля. При оценке двусторонних 95% ДИ и проверке статистических гипотез использовали традиционный для клинических исследований уровень значимости α=5%. Статистически значимыми считались различия при p<0,05.
В исследование вошли 28 женщин европеоидной расы (по 14 человек в каждой группе) в возрасте 23—58 лет с мелазмой при длительности наличия пигментации от 2 до 20 лет. У 61% пациенток отмечен неблагоприятный семейный анамнез в отношении мелазмы. Чаще всего формирование пигментации пациентки связывали с инсоляцией (82%). Среди участников исследования преобладали пациентки с III фототипом кожи (61%) и смешанным типом мелазмы (64%).
Основная и контрольная группы были сопоставимы по демографическим характеристикам, данным анамнеза и исходной степени тяжести мелазмы — статистически значимые различия по этим показателям отсутствовали (p>0,05).
У 61% пациенток исходно выявлена мелазма умеренной степени (по шкале MSS), при этом на долю поражений легкой и тяжелой степени пришлось 14% и 25% соответственно.
В популяцию для оценки эффективности вошли 27 пациенток, прошедших рандомизацию (14 пациенток из основной группы и 13 пациенток из контрольной группы). Одна пациентка контрольной группы была досрочно исключена из исследования по причине неявки на визит завершения исследования. В обеих группах отмечена положительная динамика в отношении степени выраженности мелазмы по MASI, шкалам IGA и MSS, а также по общей концентрации меланина и гемоглобина.
Динамика изменений значений анализируемых показателей эффективности свидетельствует в пользу клинического улучшения у большинства пациенток при снижении результатов оценки по MASI, шкалам IGA, MSS и концентрации хромофоров кожи (меланин и гемоглобин). Следует отметить, что у пациенток основной группы снижение показателей носило более выраженный характер, чем у пациенток контрольной группы.
После лечения снижение значений по шкале IGA отмечено у 86% пациенток основной группы и у 31% пациенток контрольной группы. При этом медиана оценки по шкале IGA уменьшилась на 67% в основной группе и на 33% в контрольной группе. Это означает, что эффективность исследуемого метода с точки зрения улучшения состояния кожи пациента вдвое превосходит метод сравнения.
У всех пациенток основной группы наблюдалось снижение степени тяжести мелазмы по шкале MSS, при этом метод сравнения позволил добиться уменьшения данного показателя лишь у 23% пациенток контрольной группы. В основной группе через 2 мес с момента начала лечения медиана оценки по шкале MSS снизилась на 50%, тогда как в контрольной группе этот показатель остался неизменным. Полного устранения мелазмы удалось добиться только у 21% пациенток основной группы.
Аналогичным образом у всех пациенток, получавших исследуемое лечение, наблюдалось уменьшение индекса MASI при снижении его медианы на 60%.
Что касается концентрации хромофоров кожи, то снижение общего уровня меланина наблюдалось у 100% пациенток основной группы и у 93% пациенток контрольной группы при снижении концентрации гемоглобина у 100% пациенток обеих групп.
В табл. 1 представлены результаты статистического сравнения индивидуальных значений анализируемых показателей в группах через 2 мес с момента начала лечения. Приведенные данные позволяют говорить о наличии статистически значимых различий показателей IGA, MSS, MASI и GAIS в основной и контрольной группах (p<0,05). При этом концентрации хромофоров кожи характеризовались сопоставимостью при p<0,05 (см. табл. 1).
Таблица 1. Статистическое сравнение значений анализируемых показателей по завершении исследования
| Показатель состояния кожи | Статистический показатель | Значения через 2 мес с начала лечения | p | |||
| основная группа (n=14) | контрольная группа (n=13) | |||||
| Шкала IGA, баллы | Me (IQR) | 2,0 | (2,0—3,5) | 4,0 | (4,0—6,0) | <0,001U |
| Шкала MSS, баллы | Me (IQR) | 1,0 | (1,0—1,8) | 2,0 | (2,0—2,0) | 0,004U |
| Степень тяжести по MSS | ||||||
| нет | n (%) | 3 | (21%) | 0 | (—) | 0,012FH |
| легкая | n (%) | 7 | (50%) | 2 | (15%) | |
| умеренная | n (%) | 4 | (29%) | 11 | (85%) | |
| тяжелая | n (%) | 0 | (—) | 0 | (—) | |
| MASI, баллы | Me (IQR) | 5,3 | (3,6—9,5) | 14,4 | (10,8—21,6) | 0,002U |
| Меланин общий уровень | M (SD) | 0,588 | (0,057) | 0,616 | (0,019) | 0,098t |
| Гемоглобин общий уровень | M (SD) | 1,103 | (0,188) | 1,076 | (0,089) | > 0,999t |
| Оценка по GAIS, баллы | Me (IQR) | 3,0 | (3,0—3,0) | 2,0 | (2,0—2,0) | 0,003U |
| Интерпретация | ||||||
| незначительное улучшение | n (%) | 0 | (—) | 3 | (23%) | 0,008FH |
| умеренно выраженное улучшение | n (%) | 3 | (21%) | 7 | (54%) | |
| значительное улучшение | n (%) | 11 | (79%) | 3 | (23%) | |
Примечание. IGA — шкала общей оценки состояния кожи исследователем (Investigator’s Global Assessment); MSS — шкала оценки степени тяжести мелазмы (Melasma Severity Scale); MASI — индекс площади и степени тяжести мелазмы (Melasma Area and Severity Index); GAIS — шкала общего эстетического улучшения (Global Aesthetic Improvement Scale); n — количество пациентов; M ― среднее значение, SD ― стандартное отклонение, Me ― медиана, IQR ― межквартильный интервал; p — значение согласно: t-критерию Стьюдента (Уэлча), U-критерию Манна―Уитни, FH-критерию Фримана―Холтона.
Результаты проведенного анализа эффективности лечения по снижению степени тяжести мелазмы подтверждают превосходство исследуемого метода над методом сравнения: нижние границы 95% ДИ разницы показателей между группами выше нуля (табл. 2).
Таблица 2. Превосходство исследуемого метода лечения по эффективности
| Показатель состояния кожи | Статистический показатель | Эффект лечения | Разница средних эффектов в группах (95% ДИ) | p | |||||
| основная группа (n=14) | контрольная группа (n=13) | ||||||||
| Шкала IGA | M (SD) | 51,8% | (27,0%) | 10,9 | (17,8%) | +41% | (+23%; | +59%) | <0,001t |
| Шкала MSS | M (SD) | 57,1% | (25,1%) | 9,0% | (17,5%) | +48% | (+31%; | +65%) | <0,001t |
| Индекс MASI | M (SD) | 59,9% | (10,8%) | 14,6 | (12,0%) | +45% | (+36%; | +54%) | <0,001t |
| Концентрация меланина | M (SD) | 7,6% | (3,9%) | 3,7% | (2,5%) | +3,9% | (+1,3%; | +6,5%) | 0,005t |
| Концентрация гемоглобина | M (SD) | 11,9% | (6,9%) | 5,5% | (4,7%) | +7,1% | (+0,5%; | +13,6%) | 0,049t |
| Оценка эстетического улучшения пациентками и врачом | |||||||||
| Показатель | Статистический показатель | В основной группе, баллы | В контрольной группе, баллы | Разница средних оценок в группах (95% ДИ), баллы | p | ||||
| Шкала GAIS | Me (IQR) | 3,0 | (3,0—3,0) | 2,0 | (2,0—2,0) | +0,8 | (+0,3; | +1,3) | 0,003U |
| Частотные показатели | |||||||||
| Событие | Доля пациентов (95% ДИ) | Разница долей (95% ДИ) | p | ||||||
| Отсутствие мелазмы или снижение ее степени до легкой (по MSS) | 71% | (45%; 88%) | 15% | (4%; 42%) | +56% | (+19%; | +76%) | 0,006φ | |
| Значительное улучшение (по GAIS) | 79% | (52%; 92%) | 23% | (8%; 50%) | +55% | (+18%; | +76%) | 0,007φ | |
Примечание. IGA — шкала общей оценки состояния кожи исследователем (Investigator’s Global Assessment); MSS — шкала оценки степени тяжести мелазмы (Melasma Severity Scale); MASI — индекс площади и степени тяжести мелазмы (Melasma Area and Severity Index); GAIS — шкала общего эстетического улучшения (Global Aesthetic Improvement Scale); n — количество пациентов; Me ― медиана, IQR ― межквартильный интервал, M ― среднее значение, SD ― стандартное отклонение; ДИ — доверительный интервал; p — значение согласно: t ― критерию Стьюдента (Уэлча); U ― критерию Манна―Уитни; φ ― точному критерию Фишера.
Проведение лечения с применением исследуемого метода и метода сравнения не привело к нарушениям общего состояния пациентов. Отсутствие НЯ позволило высоко оценить переносимость сравниваемых методов и сделать вывод о сопоставимости их профилей безопасности.
Мелазма — многофакторное заболевание, требующее тщательного подхода к выбору оптимальных методов лечения. Применение наружных средств нередко сопровождается развитием побочных эффектов [1, 3, 10]. В связи с этим исследователи ищут более эффективные методы лечения с более быстрым результатом.
Необходимо отметить, что лишь немногие лекарственные методы лечения мелазмы, указанные в российских клинических рекомендациях, обладают уровнем убедительности рекомендаций А (применение солнцезащитных средств наружно, а также транексамовая кислота в отсутствие эффекта от лечения). В основном для такой терапии характерен уровень убедительности рекомендаций В и С. Что касается аппаратных методик, то уровень убедительности рекомендаций не поднимается выше В. В связи с вышесказанным исследования, направленные на подтверждение эффективности таких подходов, не теряют своей актуальности и призваны обогатить опыт врачей-косметологов и дерматологов в лечении такого заболевания, как мелазма.
Свою эффективность при лечении мелазмы доказали фракционные абляционные CO2-лазеры. Фракционные лазеры, действие которых основано на создании микроскопических зон фототермолиза без повреждения окружающей кожи, объединяет эффективность абляционного лазерного излучения и безопасность неабляционной технологии [15, 22], что позволяет минимизировать вероятность возникновения поствоспалительной гиперпигментации и других осложнений.
В исследовании N.Y. Jalaly и соавт. фракционный CO2-лазер превзошел по эффективности лазер Nd:YAG с модуляцией добротности: после процедур воздействия CO2-лазером наблюдалось статистически значимо более выраженное снижение индекса MASI и концентрации меланина, чем после воздействия лазером Nd:YAG (p<0,001), в отсутствие серьезных НЯ в обеих группах [23].
В другом исследовании [24] с помощью CO2-лазера в комбинации с интрадермальными инъекциями транексамовой кислоты также удалось добиться существенного снижения MASI и концентрации меланина.
В качестве одного из методов эффективного лечения мелазмы недавно предложено применение АПК, механизм действия которой обусловлен содержанием большого количества факторов роста и цитокинов, оказывающих противовоспалительное, ангиогенное и регенерирующее действие, что имеет большое значение при лечении дерматологических заболеваний. В частности, при терапии мелазмы особую роль играет трансформирующий фактор роста β1, который уменьшает процесс меланогенеза посредством снижения активности тирозиназы и тирозиназа-зависимых белков [16, 17, 19, 22]. Эффективность применения АПК при лечении мелазмы отражена в проспективном исследовании, в котором у большинства пациентов отмечены отличный (6,25%), очень хороший (32,8%) и хороший (42,1%) ответы на лечение при среднем снижении модифицированного индекса MASI (modified MASI — mMASI) на 47,3% [25].
M.M. Gamea и соавт. провели сравнительное исследование, в котором пациенты одной группы в течение 12 нед использовали транексамовую кислоту (5% крем), а в другой группе топическое лечение было дополнено интрадермальными инъекциями АПК. В обеих группах после лечения отмечено значимое снижение mMASI, при этом применение АПК способствовало получению статистически значимо более высокого ответа на лечение (p=0,024) и более высокой степени удовлетворенности пациентов (p=0,029) [26].
Приведенные данные согласуются с результатами, полученными в ходе нашего исследования. В течение 2 мес с момента начала лечения комбинация методов энергетического воздействия с инъекциями АПК превзошла по эффективности метод сравнения (рисунок):
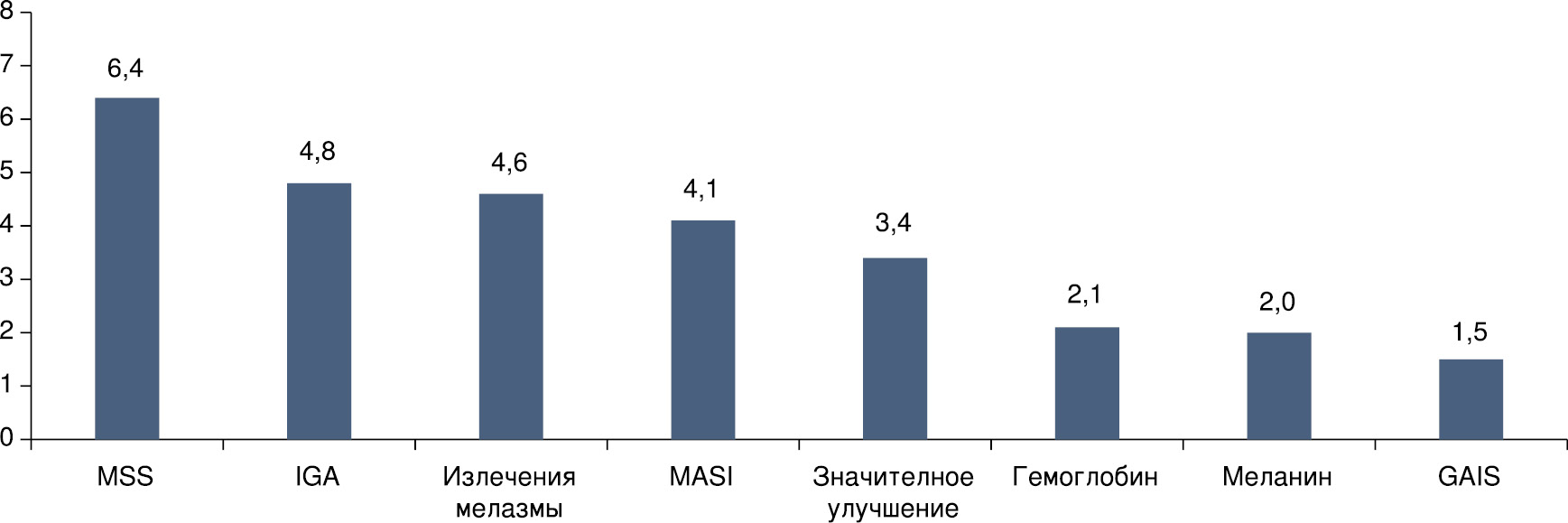
Отношение среднего эффекта в основной группе к среднему эффекту в контрольной группе.
— по шкале MSS в 6,4 раза (57,1% против 9,0%);
— по шкале IGA в 4,8 раза (51,8% против 10,9%);
— по MASI в 4,1 раза (59,9% против 14,6%);
— по доле пациентов со значительным улучшением в 3,4 раза (79% против 23%);
— по снижению концентрации гемоглобина в 2,1 раза (11,9% против 5,5%);
— по снижению концентрации меланина в 2,0 раза (7,6% против 3,7%);
— по шкале GAIS в 1,5 раза (3 балла против 2 баллов).
Показатели степени тяжести мелазмы по индексу MASI, шкалам IGA и MSS, а также результаты инструментальных измерений и оценки эстетического улучшения пациентом и врачом по шкале GAIS позволяют подтвердить, что исследуемый метод с введением АПК в дополнение к лазерной терапии и РЧ-терапии в разы превосходит контрольную терапию применения только АПК. При этом сравниваемые методы лечения характеризуются сопоставимым профилем безопасности.
Данные, полученные в ходе настоящего исследования, позволяют подтвердить синергетическое действие и безопасность методов лазерного и РЧ-воздействия в комбинации с инъекциями АПК. По сравнению с пациентками контрольной группы у пациенток основной группы через 2 мес с момента начала лечения отмечено более выраженное снижение показателей, полученных с помощью общепринятых инструментов (IGA, MSS и MASI), а также концентрации меланина и гемоглобина относительно исходного уровня. Согласно результатам исследования, подтверждено, что исследуемый метод лечения с применением АПК по эффективности превосходит метод сравнения. Вместе с тем, несмотря на неоспоримые преимущества и высокий уровень безопасности технологии АПК, необходимы дальнейшие рандомизированные контролируемые исследования, которые позволят более глубоко изучить особенности применения АПК в виде монотерапии и в комбинации с другими методами лечения.
Авторы заявляют об отсутствии конфликта интересов.
Литература / References:
Подтверждение e-mail
На test@yandex.ru отправлено письмо со ссылкой для подтверждения e-mail. Перейдите по ссылке из письма, чтобы завершить регистрацию на сайте.
Подтверждение e-mail
Мы используем файлы cооkies для улучшения работы сайта. Оставаясь на нашем сайте, вы соглашаетесь с условиями использования файлов cооkies. Чтобы ознакомиться с нашими Положениями о конфиденциальности и об использовании файлов cookie, нажмите здесь.